Selskapet har fått navnet NaDeNo, og er i gang med å utvikle en ny kur mot kreft som har spredt seg til bukhulen. Selskapet er en spin-off fra SINTEF, hvor teknologien ble utviklet, og er basert på over ti års forskning på nanomedisin.
I 2012 startet det som ble grunnlaget for NaDeNo. Den første forskningen ved SINTEF ga lovende resultater. Nå tas teknologien og patentene ut av forskningsinstituttet og inn i en egen bedrift.
Teknologien som er utviklet gjør det mulig å pakke store mengder med aktiv kreftmedisin inn i nanopartikler. Partiklene injiseres i bukhulen og medisinen fordeles jevnt slik at den når alle svulster i bukhinnen.
Mye medisin – men kun til kreftsvulsten
Forsøk på mus og rotter viser at nanopartiklene hoper seg opp i kreftsvulsten og gir mer medisin til kreftcellene og mindre til de friske cellene.
– Med et solid fundament i forskningen fra SINTEF har vi allerede klart å komme langt i utviklingen av teknologien. Får vi de resultatene som vi ønsker, kan teknologien bli svært betydningsfull for fremtidig behandling av kreft i bukhinnen, men også for andre sykdommer, sier Ýrr Mørch, CTO og medgründer i NaDeNo.
Men, for å kunne gjøre teknologien tilgjengelig for kreftpasienter, må den først testes grundig, og kunne produseres i større skala. Den må være både trygg og effektiv.
– Vi gjør oss nå klare for å starte full preklinisk testing. Denne fasen vil vare noen år. Vi skal gjøre flere dyreforsøk med standardiserte metoder. Vi må teste produktet grundig, og vise at kreftmedisinen er sikker og at den kan produseres med medisinsk renhet, sier Mørch.
– Kroppen består i stor grad av vann. Stoffer som er dårlig oppløselige i vann, er vanskelige å få fraktet til riktig sted i kroppen i høye nok doser, som får virke lenge nok til at man får god effekt, men uten alvorlige bivirkninger.
Deretter vil selskapet søke om å gjøre kliniske forsøk i mennesker.
– Nå produseres nanopartiklene i lab-skala hos SINTEF, men vi må vise at vi kan produsere i industriell skala. Dette må gjøres hos spesialiserte produsenter og per i dag må vi utenfor Norge for å få det til, sier Mørch. Det er en god del forskning som gjenstår før teknologien kan benyttes i mennesker. Vi er fortsatt i tidligfase.

Resultater fra forsøk på ulike kreftsvulster på mus, viser at kun én injisering av den nye medisinen var nok til å få bort kreftsvulsten. Illustrasjonsfoto: Shutterstock
Vanskelig å behandle kreft i bukhinnen
Kreft i bukhinnen er en kreftform som er vanskelig å oppdage og behandle. Den oppstår ofte som følge av spredning fra kreft i andre organer, slik som eggstokkreft og tarmkreft. Dersom kreften spres til bukhinnen, vil det gi få symptomer og kreften oppdages ofte for sent. Prognosene for overlevelse er dårlige.
Dagens behandlingsmetoder er ikke standardiserte, og de er gjerne livsforlengende og ikke-kurerende.
Pasienter som får denne diagnosen blir ofte behandlet kirurgisk ved at alt synlig kreftvev blir fjernet, før en behandler med cellegift – enten gitt lokalt eller til hele kroppen via blodet. Utfordringen er da at medisinen enten oppholder seg for kort tid i bukhulen eller at medisinen ikke når fram til bukhulen og kreftcellene.
– Dette er på grunn av barrieren som finnes mellom blodet og bukhinnen, forteller Annbjørg Falck, administrerende direktør og medgründer i NaDeNo.
For at kreftmedisinen skal kunne virke i kroppen, er en avhengig av at medisinen er i løselig form. Mange cellegifter er imidlertid småmolekylære legemidler som er lite vannløselige. Cellegiftene er derfor vanskelige å levere på en optimal måte til sykdomsstedet.
– Kroppen består i stor grad av vann. Stoffer som er dårlig oppløselige i vann, er vanskelige å få fraktet til riktig sted i kroppen i høye nok doser, som får virke lenge nok til at man får god effekt, men uten alvorlige bivirkninger.
Små partikler med enorm overflate
NaDeNo vil løse dette med å kapsle inn cellegiften i små nanopartikler. Partiklene blir injisert direkte inn i bukhulen via en væskeløsning som gjør at nanopartiklene fordeles jevnt og når alle svulstene i bukhinnen. Nanopartiklene frigjør så medisinen på sykdomsstedet.
– Denne medisinen er dårlig løselig i vann når den er «naken», men inni nanokapselen som er utviklet hos SINTEF er den godt løselig. Kapselen hjelper medisinen med å komme til rett sted. Når partikkelen brytes ned kommer legemiddelet ut, sier Mørch.
- Les også: På sporet av medisin mot flere sykdommer
I forsøk på mus og rotter har forskerne sett at nanopartiklene hoper seg opp i kreftsvulstene som ligger i bukhinnen. Vi får derfor mer medisin til kreftcellene, og mindre til de friske cellene.
– Kombinert med god spredning av medisin i hele bukhulen og en lengre oppholdstid på medisinen, viser forsøkene på mus og rotter at de ser ut til å tåle medisinen bedre på denne måten.
Og det er flere fordeler:
– Fordi nanopartiklene er så små har de en stor overflate i forhold til volum. Per milliliter får vi 10¹² partikler, det vil si milliarder av partikler. Totalt sett blir det en enorm overflate som kan reagere med omgivelsene, for eksempel ved å feste seg til forskjellig vev eller celler i kroppen.
Nanopartiklene får dermed evne til å levere store mengder med legemiddel til sykdomsstedet.
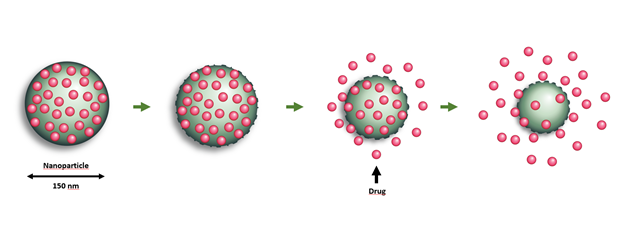
NaDeNo utvikler en teknologi hvor små legemidler som normalt er vanskelig å levere i kroppen, kapsles inn i bittesmå nanopartikler. Når nanopartiklene injiseres i kroppen, transporterer de legemiddelet effektivt til målet, hvor partiklene brytes ned og frigjør medisinen over tid. Illustrasjon: SINTEF/NaDeNo.
Bruker en effektiv cellegift
Produktet som NaDeNo utvikler er altså en nanoteknologisk plattform for innkapsling av ikke-vannløselige (hydrofobe) legemidler i nanopartikler. Behovet for å levere slike legemidler er nemlig stort.
– Lykkes vi med det første produktet vil det bety at vi kan tilby en leveringsteknologi som vil være nyttig for både farmasøytiske og bioteknologiske selskaper, sier Mørch.
Cellegiften selskapet bruker er cabazitaxel. Denne cellegiften er veldig effektiv, men med dagens levering av medisinen gir den også store bivirkninger hos pasienten.
– I dag brukes cabazitaxel kun til behandling av prostatakreft. Virkestoffet er veldig lite vannløselig og også svært giftig. Det er derfor begrenset hvor mye medisin en kan gi, uten at det oppstår alvorlige bivirkninger, forteller Eide Falck.
Siden cabazitaxel er så lite vannløselig er det utfordrende å utvikle nanopartikkelformuleringer av legemiddelet. Selskapet må vise at cabazitaxel innkapslet i nanopartikler gir en tilleggseffekt utover behandlingen med cellegift som benyttes i dag til å behandle pasienter som har fått spredning av kreft til bukhulen.
– Cabazitaxel viser mindre resistensutvikling enn andre lignende cellegifter, og er svært potent. En ny og optimalisert leveringsmetode for denne medisinen vil derfor kunne gi flere pasienter nytte av dette effektive legemiddelet.

Illustrasjon av cellegiften cabazitaxel (rødt) innkapslet i nanopartikler. Materialet som benyttes til innkapsling er en nedbrytbar syntetisk polymer (grønt). Det samme materialet har i mange år vært brukt til å lime sammen sår. Polymeren brytes ned i kroppen over tid og forsvinner av seg selv. Illustrasjon: SINTEF/NaDeNo
Kan brukes til kurering av flere typer sykdommer
Utviklingen av nanopartikkel-teknologien har fram til nå foregått i tett samarbeid med Radiumhospitalet. Sykehuset har høy kompetanse på kreftbehandling og behandler mange pasienter årlig.
Samarbeidet med sykehuset gir NaDeNos første utviklingskandidat en viktig klinisk forankring. Gjennom samarbeidet har selskapet fått tilgang til representative musemodeller på human kreft, med svært lovende resultater.
– Radiumhospitalet behandler pasienter som har fått spredning av kreft til bukhulen etter høy internasjonal standard. Det vil si at det først utføres kirurgi hvor alt synlig tumorvev fjernes, før bukhulen skylles med oppvarmet cellegift. Denne metoden kalles på fagspråket HIPEC. I noen tilfeller gir dette en bedre effekt ved at medisinen leveres direkte til kreftsvulstene i bukhinnen. Behandlingen er imidlertid tøff for pasientene – som er svært syke. Cellegiften har kort oppholdstid i buken og havner raskt andre steder i kroppen, sier Mørch.
Kjersti Flatmark, professor og overlege i gastrokirurgi ved Radiumhospitalet er meget positiv til samarbeidet med NaDeNo og SINTEF.
– Kreftspredning til bukhinnen er vanskelig å behandle og har svært dårlig prognose. Dessverre vil dagens behandling sjelden helbrede pasientene, og behovet for bedre behandlingsalternativer er derfor åpenbart. Samarbeidet med SINTEF og nå NaDeNo har vært spennende å være med på, og har til nå fokusert på utvikling og testing av teknologien i modellsystemer. Vi håper at levering av cellegift pakket inn i nanopartikler på sikt vil bidra til økt behandlingseffekt og til at flere pasienter kan bli helt friske, forteller hun.
Pasientgruppen som NaDeNo nå i første omgang retter seg mot utgjør om lag 37 000 personer årlig i Europa og USA. Selskapet har for øvrig ambisjoner om at teknologien også skal kunne brukes til flere pasienter.
– Hvis den første løsningen nå fungerer, vil vi få en god pekepinn på at vi har en teknologi som kan brukes til behandling av flere typer kreftsykdommer som per i dag er vanskelig å behandle, sier Ýrr Mørch.
Få teknologien ut i markedet
SINTEFs kunnskap både innen design og karakterisering av leveringsplattformer har gjort forskningsinstituttet til en attraktiv partner innen nanomedisinfeltet, både nasjonalt og internasjonalt. Blant annet deltok SINTEF mellom 2015-2020 i det EU-finansierte prosjektet European Nanomedicine Characterization Laboratory (EU-NCL) sammen med seks europeiske partnere og amerikanske National Cancer Institute (NCI).
I august 2022 ble NaDeNos første utviklingskandidat akseptert av NCI som en lovende nanomedisin. NCI utfører et standardisert preklinisk testprogram kostnadsfritt. Målet er å akselerere utviklingen av nanomedisiner med potensiale for å kunne behandle pasienter med livstruende sykdommer, hvor det per i dag er et stort medisinsk behov.
– Å bli tatt opp i NCI sitt prekliniske testprogram er en svært viktig milepæl for oss, som gir en verdifull validering av utviklingsprogrammet vårt. Kravene for å bli tatt opp er høye, så dette viser oss at SINTEF sitt arbeid gjennom mange år holder høy internasjonal standard, sier Falck.
Heidi Johnsen, forskningsleder for gruppen i SINTEF som var med å utvikle teknologiplattformen i NaDeNo, ser frem til fortsettelsen for spinn-off-en.
– I SINTEF arbeider vi med teknologi for et bedre samfunn, og jeg er stolt av det vi har fått til så langt. Vi i SINTEF vil bidra så godt vi kan for at NaDeNo lykkes med sine produkter gjennom fortsatt godt samarbeid, sier hun.
– Vår strategi er nå å sikre solid finansiering framover, med mål om å ta vårt første produkt ut i markedet til pasientene, samtidig som vi utvikler den teknologiske plattformen. I denne sammenheng ønsker vi å knytte til oss partnere innenfor bioteknologi og farmasøytisk industri, som har behov for nye og bedre måter å levere lite vannløselige legemidler på, avslutter Annbjørg Falck.
Fakta om selskapet NaDeNo:
NaDeNo er et spin-off fra SINTEF etablert i 2022, som har som mål å bringe nye nanomedisiner til pasienter og tilby sin teknologiløsning til farmasøytiske og bioteknologiske selskaper.
Nåværende ledergruppe i NaDeNo er Annbjørg Eide Falck, administrerende direktør og medgründer, med en mastergrad i farmasi og en MBA, og Ýrr Mørch, CTO og medgründer, som er en av oppfinnerne av teknologien, med doktorgrad i bioteknologi fra NTNU.
Fremtidige viktige milepæler vil omfatte teknisk overføring og oppskalering av produksjonsprosessen til et Good Manufacturing Practices (GMP)-anlegg, fullføring av den formelle prekliniske fasen og oppstart av første klinisk studie i mennesker. Viktige partnere for å nå disse milepælene er SINTEF, og NCI-NCL (NCI Nanotechnology Characterization Laboratory) i USA. Videre har NaDeNo et tett samarbeid med Radiumhospitalet.
NaDeNo gjennomførte nylig sin første kapitalinnhenting. De har fått med seg norske investorer både i Trondheim og ellers i landet - som har gode erfaringer med å investere i selskaper som spinnes ut fra SINTEF. Selskapet fikk i disse dager også innvilget søknad om IPN-prosjekt fra Forskningsrådet. Dette er en viktig milepæl for at selskapet skal kunne fortsette med forskning og utvikling av teknologiplattformen og nye nanomedisiner i tett samarbeid med SINTEF. NaDeNo vil i tillegg arbeide for å skaffe ytterligere «soft funding» knyttet til det første produktet i porteføljen.