Betennelsessykdommer som KOLS og sepsis (blodforgiftning) er en voksende trussel mot folkehelsa. Ofte er slike tilstander resultatet av et overaktivt immunforsvar. Derfor vekker funnet av legemiddelkandidaten TH5487 oppsikt. Molekylet har evne til å avvæpne et protein som viser seg å spille en viktig rolle i betennelsessykdommer. Dette har i forsøk vist seg å dempe lungebetennelse i mus.
Oppdagelsen er gjort av forskere ved Karolinska Institutet i Stockholm, Stockholms Universitet, University of Texas, samt NTNU og SINTEF i Trondheim. Etter et fem år langt forskningsløp presenteres nå resultatene i det prestisjetunge tidsskriftet Science.
Startet som grunnforskning
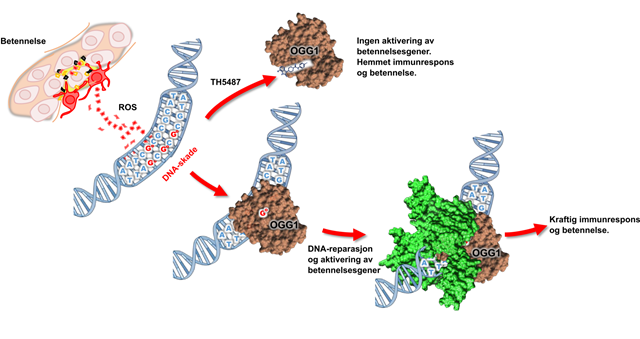
Hovedrollen i denne sammenhengen innehas av et enzym – det vil si et aktivt protein (OGG1) som har som oppgave å reparere skadet DNA i cellene våre. Denne reparasjonen viser seg å være en slags startknapp for immunrespons i kroppen vår.
Det var SINTEF-forsker Torkild Visnes som fattet interesse for dette enzymet da han for fem år siden fikk en post-doc-stilling hos Karolinska, etter å ha jobbet med doktorgraden sin på kreftforskning ved NTNU.
Han og kollegene ved Karolinska fikk etter hvert en hypotese om at dette reparasjons-proteinet kunne være spille en viktig rolle i betennelsesreaksjoner eller andre typer sykdom, og ville derfor utvikle et stoff som kunne hemme proteinet i levende celler.
– Det kan høres ulogisk ut, men i mange sykdommer er et overaktivt immunapparat selve problemet, utdyper Visnes.
Viktig signalstoff skaper overaktivitet
Pasienter med betennelsessykdom har mye av et signalstoff som på det biokjemiske språket kalles ROS. ROS er en forkortelse for «reactive oxygen species» og setter i gang betennelser, og skader cellenes arvestoff, DNA.
– Disse skadene repareres av enzymet OGG1, altså startknappen som gjør immunsystemet overaktivt for de med auto-immune sykdommer.
Dette stemmer med tidligere forskning som viser at mus som mangler OGG1 ikke klarer å aktivere en kraftfull immunrespons, og derfor får mildere betennelser enn normale mus.
– Tidligere har vi trodd at ROS skadet DNA’et på en tilfeldig måte. Men nå virker det som om disse endringene kanskje ikke er skader i det hele tatt, men derimot del av en normal immunrespons, forklarer Visnes. Men dette er noe vi må forske mer på.
Studerte 18000 stoffer manuelt
I 2013 begynte forskerteamet å jakte på en mulighet for å gjøre enzymet OGG1 mindre aktivt.
– Ideén vår var å søke etter et kjemisk stoff som ville feste seg til reparasjonsproteinet. Dette stoffet skulle brukes til å «avvæpne» proteinet gjennom å lure det: Innbille proteinet at det allerede hadde funnet skadd DNA, og dermed pasifisere det. Med andre ord: frata proteinet evnen til å igangsette overaktiv immunrespons.
Slik fungerer molekylet TH5487. Det lurer reparasjons-enzymet til å tro at det allerede har funnet DNA. Dermed utløser det ikke en sterkere betennelse. Illustrasjon: SINTEF.
– Jeg hadde tidligere jobbet mye med å måle aktiviteten i denne typen enzymer, men med svært arbeidskrevende metoder, forteller Visnes.
Men gjennom å utvikle en metode som gjorde det mulig å lese av enzymaktiviteten ved hjelp av fluorescens – altså å gjøre reparert DNA selvlysende- kunne vi lese av tusenvis av prøver på bare noen få timer
Etter å ha sjekket 18000 mulige stoffer for egenskaper som kunne lure reparasjons-enzymet, satt forskerne igjen med ett stoff som klarte å deaktivere OGG1. Det hadde tatt ett år.
Videreutviklet molekylet i laben
Deretter begynte en møysommelig prosess for å forbedre stoffet, slik at det fikk alle egenskaper som trengs for å virke i en levende celle.
I en periode på to år laget forskerne omtrent tusen små varianter av stoffet. Til sist satt de igjen med den unge og lovende TH5487, som rett og slett fikk navnet sitt fordi det kom etter stoffet som ble laget før, og som heter TH5486.
Dette stoffet viste seg å ha alle de tre viktige egenskapene forskerne søkte:
- Det hang seg på betennelsesproteinet OGG1 slik at det ble passivisert og ikke kan binde til DNA.
- Det kunne deaktivere OGG1 også i celler som var levende
- Det var svært stabilt når det ble sprøytet inn i dyr.
Friske(re) mus i Texas
Gjennombruddet kom da forskere ved University of Texas testet stoffet i mus med alvorlig betennelse i lungene.
TH5487 kunne raskt og effektivt stoppe lungecellene fra å aktivere betennelsesgener. Dermed kunne heller ikke immunceller merke den begynnende betennelsen, og holdt seg unna lungene. Lungebetennelsen ble derfor oppsiktsvekkende mye bedre. Forskerteamet tror derfor de har funnet en ny måte å dempe inflammasjon på, som kan brukes i stedet for eller tillegg til eksisterende behandlinger.
Målet er å lage en medisin som kan virke på mennesker.
– Veien dit er lang, reglene kompliserte og kostnadene store. Men vi har tro på at vi nå har funnet en brikke som kan få stor betydning i behandling av alt fra auto-immune sykdommer til blodforgiftning, sier SINTEF-forskeren som nå ønsker å bygge opp et eget fagmiljø innenfor biokjemi knyttet til DNA og legemiddelutvikling i Trondheim.

